抽象的
簡介:衰老的特點是生理能力的逐漸喪失。在細胞水平上,衰老過程的兩個關鍵標志包括端粒長度 (TL) 縮短和細胞衰老。使用某些高壓氧療法 (HBOT) 協議重復間歇性高氧暴露可以誘導再生效應,這通常發生在缺氧期間。本研究的目的是評估 HBOT 是否影響正常、非病理性、老齡化成年人群中的 TL 和衰老細胞濃度。
方法:招募了 35 名 64 歲及以上的健康獨立生活成年人,每天接受 60 次 HBOT 暴露。在基線、第 30次和第60次會話以及最后一次 HBOT 會話后 1-2 周收集全血樣本。評估了外周血單個核細胞 (PBMC) 端粒長度和衰老。
結果: HBOT 后,T 輔助細胞、T 細胞毒性細胞、自然殺傷細胞和 B 細胞的端粒長度顯著增加了 20% 以上。最顯著的變化出現在 B 細胞中,在第 30次、第60次和 HBOT 后增加了 25.68%±40.42 (p=0.007)、29.39%±23.39 (p=0.0001) 和 37.63%±52.73 (p) =0.007),分別。
HBOT后衰老T輔助細胞的數量顯著減少-37.30%±33.04(P<0.0001)。T 細胞毒性衰老細胞百分比在 HBOT 后顯著降低 -10.96%±12.59 (p=0.0004)。
總之,該研究表明,HBOT 可能會誘導顯著的衰老作用,包括顯著增加端粒長度和老齡化人群中衰老細胞的清除。
介紹
衰老的特征在于生理完整性的逐漸喪失,導致功能受損以及疾病和死亡的易感性。這種生物退化被認為是癌癥、心血管疾病、糖尿病和阿爾茨海默病等的主要風險因素。在細胞水平上,衰老過程有兩個關鍵標志:端粒長度縮短和細胞衰老 [ 1 ]。
端粒是位于染色體末端的串聯核苷酸重復序列,可維持基因組的穩定性。由于固有的無法完全復制滯后 DNA 鏈的末端部分,端粒在復制(有絲分裂)過程中會縮短 [ 2 ]。端粒長度(TL),4至15個堿基之間測量,逐漸縮短每年由?20-40個堿基,并與不同的疾病,低物理性能和大腦[的皮質變薄相關聯3 - 5 ]。當 TL 達到臨界長度時,細胞無法復制并進入衰老或程序性細胞死亡 [ 6 ]。戈格林等人。證明具有較短 TL 的成年人死亡率增加 [ 7]]。縮短的 TL 可能是直接遺傳特征,但一些環境因素也與縮短 TL 相關,包括壓力、缺乏體力活動、體重指數過高、吸煙、慢性炎癥、維生素缺乏和氧化應激 [ 2 , 8 , 9] ]。
細胞衰老是細胞周期的停滯,這可能由端粒縮短 [ 10 ] 以及其他與 TL 無關的衰老相關刺激引起,例如非端粒 DNA 損傷 [ 1 ]。衰老的主要目的是通過免疫系統觸發它們的消除來防止受損細胞的繁殖。衰老細胞隨著衰老而積累,反映了這些細胞生成的增加和/或清除率的降低,這反過來又會加劇損傷并促進衰老[ 1 ]。
越來越多的研究發現了幾種可以降低端粒縮短率的藥物 [ 11 , 12 ]。包括耐力訓練、飲食和針對細胞代謝和氧化應激的補充劑在內的幾種生活方式干預措施對 TL 3 的影響相對較小 (2-5%) , [ 2 , 8 , 9 ]。
高壓氧療法 (HBOT) 在高于一個絕對大氣壓 (ATA) 的環境壓力下利用 100% 的氧氣來增加溶解在身體組織中的氧氣量。重復間歇性高氧暴露,使用某些 HBOT 協議,可以誘發生理效應,這通常發生在高氧環境中的缺氧期間,即所謂的高氧缺氧悖論 [ 13 – 16 ]。此外,最近證明 HBOT 可以通過涉及腦血流區域變化的機制誘導健康老年人的認知增強 [ 17]]。在細胞水平上,已證明 HBOT 可誘導缺氧誘導因子 (HIF)、血管內皮生長因子 (VEGF) 和沉默調節蛋白 (SIRT)、干細胞增殖、線粒體生物發生、血管生成和神經發生的表達 [ 18 ]。然而,迄今為止還沒有研究檢查過 HBOT 對 TL 和衰老細胞積累的影響。
本研究的目的是評估 HBOT 是否影響老年人的 TL 和衰老樣 T 細胞群。
結果
35 個人被分配到 HBOT。五名患者未完成基線評估并被排除在外。完成基線評估的所有 30 名患者均完成了干預。由于血液樣本質量低(細胞數量少或技術人員錯誤),4 名患者被排除在端粒分析之外,10 名患者被排除在衰老細胞分析之外(圖 1)。表1中提供了排除患者后隊列的基線特征和比較。三組之間沒有顯著差異(表1)。
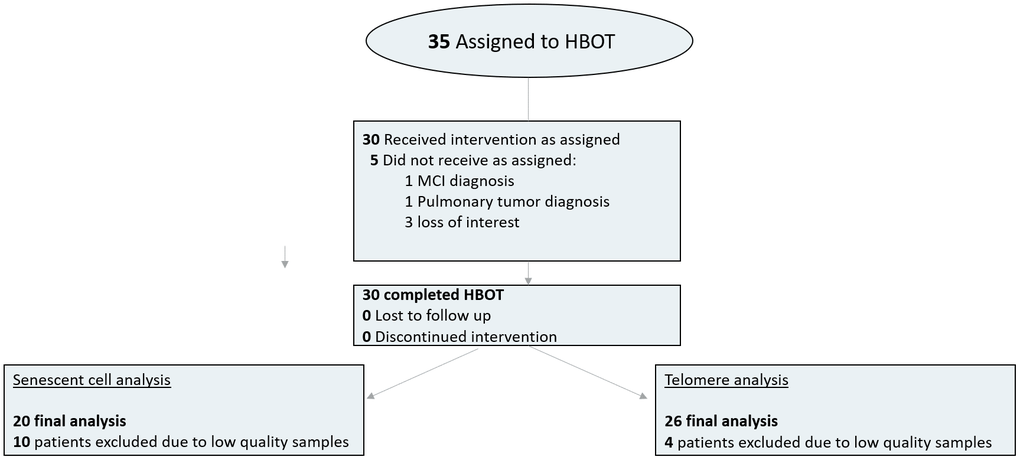
圖 1. 患者流程圖。
表 1. 基線特征。
|
|
|
熱電偶
|
端粒分析
|
衰老分析
|
P值
|
|
N
|
|
30
|
25 (83.3%)
|
20 (66.6%)
|
|
|
年齡(歲)
|
|
68.41±13.2
|
67.56±14.35
|
66.70±16.00
|
0.917
|
|
體重指數
|
|
26.77±3.20
|
26.89±3.34
|
27.14±3.81
|
0.946
|
|
男性
|
|
16 (53.3%)
|
13 (52.0%)
|
10 (50.0%)
|
0.987
|
|
女性
|
|
14 (47.7%)
|
12 (48.0%)
|
10 (50.0%)
|
0.987
|
|
全血細胞計數
|
|
|
|
|
|
|
|
血紅蛋白
|
6.33±1.25
|
6.57±1.15
|
6.58±1.29
|
0.707
|
|
|
白血細胞
|
14.02±1.40
|
13.92±1.35
|
13.97±1.49
|
0.969
|
|
|
%PBMC
|
39.96±6.75
|
39.25±6.64
|
38.59±6.63
|
0.774
|
|
|
血小板
|
239.87±1.39
|
244.08±43.0
|
254.05±41.4
|
0.559
|
|
慢性病
|
|
|
|
|
|
|
心房顫動
|
4 (13.3%)
|
4 (16.0%)
|
2 (10.0%)
|
0.841
|
|
|
甲狀腺功能減退癥
|
4 (13.3%)
|
4 (16.0%)
|
3 (15.8%)
|
0.956
|
|
|
阻塞性睡眠呼吸暫停
|
4 (13.3%)
|
4 (16.0%)
|
3 (15.0%)
|
0.961
|
|
|
哮喘
|
1 (3.3%)
|
1 (4.0%)
|
0
|
0.680
|
|
|
前列腺增生癥
|
7 (23.3%)
|
5 (20.0%)
|
6 (30.0%)
|
0.733
|
|
|
GERD
|
3 (10%)
|
2 (8.0%)
|
2 (10.0%)
|
0.961
|
|
|
骨質疏松癥
|
5 (16.7%)
|
5 (20.0%)
|
4 (20.0%)
|
0.936
|
|
|
風濕性關節炎
|
1 (3.3%)
|
0
|
1 (5.0%)
|
0.561
|
|
|
骨關節炎
|
7 (23.3%)
|
4 (16.0%)
|
5 (25.0%)
|
0.755
|
|
|
糖尿病
|
3 (10%)
|
3 (12.0%)
|
2 (10.0%)
|
0.966
|
|
|
高血壓
|
7 (23.3%)
|
5 (20.0%)
|
5 (25.0%)
|
0.918
|
|
|
血脂異常
|
16 (53.3%)
|
14 (56.0%)
|
12 (60.0%)
|
0.897
|
|
|
缺血性心臟病
|
2 (6.7%)
|
1 (4.0%)
|
2 (10.0%)
|
0.725
|
|
|
吸煙史
|
10 (33.3%)
|
8 (32.0%)
|
7 (35.0%)
|
0.978
|
|
慢性藥物
|
|
|
|
|
|
|
反聚合
|
8 (26.7%)
|
6 (24.0%)
|
5 (25.0%)
|
0.974
|
|
|
ACE抑制劑/ARB阻滯劑
|
6 (20%)
|
6 (24.0%)
|
6 (30.0%)
|
0.720
|
|
|
β受體阻滯劑
|
5 (16.7%)
|
5 (20.0%)
|
3 (15.0%)
|
0.901
|
|
|
鈣阻滯劑
|
3 (10%)
|
3 (12.0%)
|
2 (10.0%)
|
0.966
|
|
|
阿爾法受體阻滯劑
|
7 (23.3%)
|
5 (20.0%)
|
6 (30.0%)
|
0.733
|
|
|
利尿劑
|
2 (6.7%)
|
1 (4.0%)
|
1 (5.0%)
|
0.906
|
|
|
他汀類藥物
|
10 (33.3%)
|
9 (36.0%)
|
7 (35.0%)
|
0.978
|
|
|
口服降糖藥
|
1 (3.3%)
|
1 (4.0%)
|
1 (5.0%)
|
0.958
|
|
|
雙膦酸鹽
|
1 (3.3%)
|
1 (4.0%)
|
1 (5.0%)
|
0.958
|
|
|
質子泵抑制劑
|
3 (10%)
|
3 (12.0%)
|
3 (15.0%)
|
0.726
|
|
|
激素
|
3 (10%)
|
3 (12.0%)
|
2 (10.0%)
|
0.966
|
|
|
苯二氮卓類
|
3 (10%)
|
2 (8.0%)
|
1 (5.0%)
|
0.816
|
|
|
SSRI
|
5 (16.7%)
|
5 (20.0%)
|
3 (15.0%)
|
0.990
|
端粒長度
與基線相比,第 30次和 HBOT 后T 輔助端粒長度顯著增加21.70±40.05 (p=0.042)、23.69%±39.54 (p=0.012) 和 29.30±38.51 (p=0.00) ),分別(圖2)。然而,重復測量分析顯示出不顯著的趨勢(F=4.663,p=0.06,表 2和圖 2)。
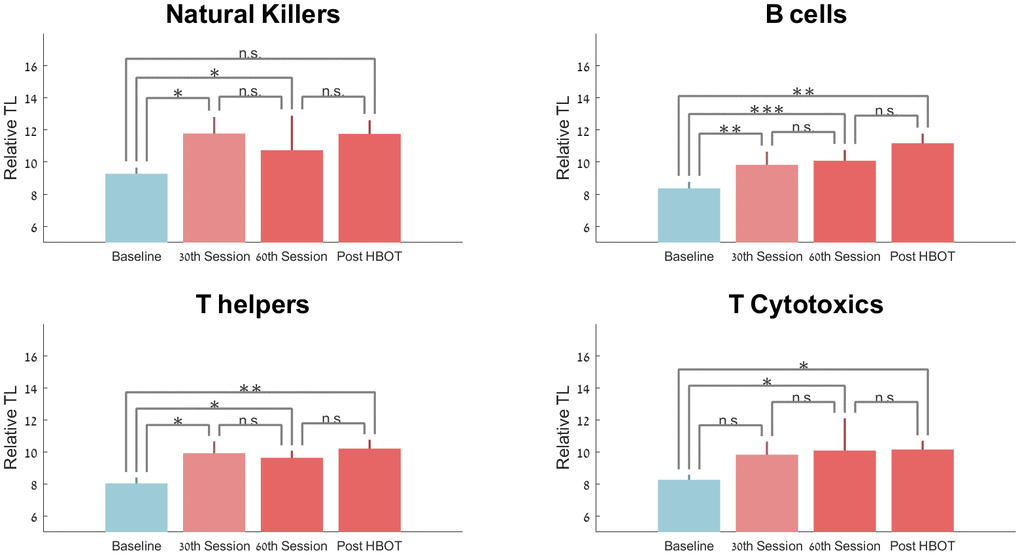
圖 2. 端粒長度隨 HBOT 的變化。平均值+SEM *p<0.05,**p<0.01,***p<0.001。
表 2. HBOT 后端粒長度和衰老細胞的變化。
|
|
|
絕對的變化
|
相對變化 (%)
|
重復測量 F (p)
|
|
PBMC
|
基線
|
第30屆
|
|
第60屆會議
|
后 HBOT
|
第30屆
|
第60屆會議
|
后HBOT
|
|
PBMC ((N=25)
|
2.55±0.53
|
|
|
|
-0.15±0.40
|
|
|
-4.91±16.70
|
1.987 (噸) 0.09
|
|
PBMC (N=20)
|
2.50±0.53
|
|
|
|
-0.13±0.31
|
|
|
-4.21±11.99
|
1.810 (噸) 0.07
|
|
相對端粒長度 (N=25)
|
|
自然殺手
|
9.27±1.91
|
11.77±5.14 (0.045)
|
|
10.73±2.73 (0.013)
|
11.75±4.22 (0.06)
|
25.02±51.42
|
20.56±33.35
|
22.16±44.81
|
0.812 (0.391)
|
|
B細胞
|
8.36±2.02
|
10.22±3.04 (0.007)
|
|
11.23±3.58 (0.0001)
|
11.17±2.98 (0.007)
|
25.68±40.42
|
29.39±23.39
|
37.63±52.73
|
7.390 (0.017)
|
|
幫手
|
8.04±1.82
|
9.92±3.68 (0.042)
|
|
9.63±2.17 (0.012)
|
10.20±2.77 (0.005)
|
21.70±40.05
|
23.69±39.54
|
29.30±38.51
|
4.663 (0.063)
|
|
細胞毒
|
8.26±1.54
|
9.83±4.08 (0.11)
|
|
10.08±3.33 (0.019)
|
10.15±2.74 (0.023)
|
18.29±45.62
|
24.13±40.88
|
19.59±33.98
|
1.159 (0.310)
|
|
衰老細胞(T 細胞的百分比)(N=20)
|
|
幫手
|
10.29±5.42
|
7.84±7.09 (0.09)
|
|
8.51±7.45 (0.20)
|
6.22 ± 4.88 (< 0.0001 )
|
-19.66±80.03
|
-11.67±94.30
|
-37.30±33.04
|
8.548 (0.01)
|
|
細胞毒
|
52.19±21.07
|
45.53 ± 19.91 (< 0.0001 )
|
|
45.45±18.81 (0.002)
|
46.59±21.91 (0.0004)
|
-12.21±8.74
|
-9.81±9.50
|
-10.96±12.59
|
6.916 (0.018)
|
|
() 中顯示的 P 值與基線相比。
|
|
粗體的 P 值 <0.05。
|
與基線相比,B 細胞的端粒長度在第 30次、第60次和 HBOT 后顯著增加25.68%±40.42(p=0.007)、29.39%±23.39(p=0.0001)和 37.63%±52.73( p=0.007),分別(圖2)。重復測量分析顯示了顯著的組內效應(F=0.390,p=0.017,表 2和圖 2)。
與基線相比,自然殺傷細胞端粒長度在第 30次會議 (p=0.045) 和第 60次會議時顯著增加了 20.56% ±33.35 (p=0.013)。HBOT 后,端粒長度在 HBOT 后增加了 22.16%±44.81(p=0.06,表 2和圖 2)。重復測量分析表明,在第 30次會議后沒有額外的顯著影響(F=0.812,p=0.391)。
與基線相比,細胞毒性 T 細胞在第 30次會話時無顯著增加18.29%±45.62 (p=0.11),隨后在第 60次會話時顯著增加 24.13%±40.88 (p=0.0019) HBOT 后為 19.59%±33.98(p=0.023)。重復測量分析表明,在第 30次會議后沒有額外的顯著影響(F=1.159,p=0.310,表 2和圖 2)。
衰老細胞
第 30次和第60次的衰老 T-helper 數量分別下降-19.66%±80.03 (p=0.09) 和 -11.67%±94.30 (p=0.20)。然而,HBOT后衰老T輔助細胞的數量顯著下降-37.30%±33.04(P<0.0001,圖3)。重復測量分析表明,即使在第 30次會議之后,仍具有顯著的持續效應,具有組內效應(F=8.547,p=0.01,表 2和圖 3)。
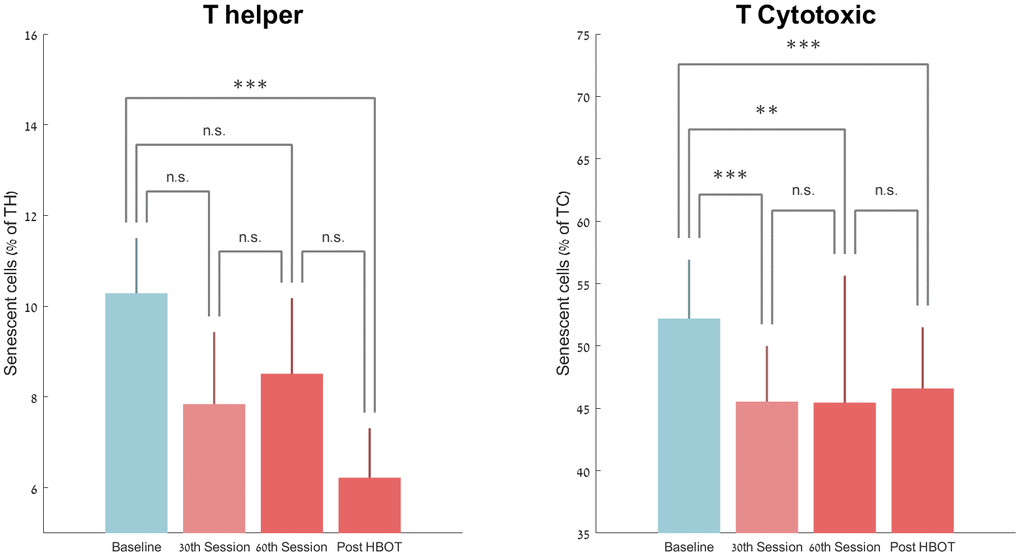
圖 3. HBOT 引起的衰老細胞變化。平均值+SEM *p<0.05,**p<0.01,***p<0.001。
T 細胞毒性衰老細胞百分比在第 30次HBOT 會話時顯著下降 -12.21%±8.74 (P<0.0001),在第60次HBOT 會話時-9.81%±9.50 (0.002) 和 -10.96%±12.59 (p=0.000) )后 HBOT(表 2和圖 3)。重復測量分析顯示即使在第 30次會議之后仍具有顯著的持續效應,具有組內效應(F=6.916,p=0.018,表 2)。
HIF-1α
HIF-1alpha 水平在第 60次會議時從 10.54±3.39 增加到 19.71±3.39 (p=0.006),其中 HBOT 后 2 周水平 16.81±7.65 與基線沒有顯著差異 (p=0.16)。
討論
在這項研究中,首次在人類中發現重復的每日 HBOT 會話可以使老齡化人群的 PBMC 端粒長度增加 20% 以上,其中 B 細胞的變化最為顯著。此外,HBOT 將衰老細胞的數量減少了 10-37%,其中 T 輔助衰老細胞受到的影響最大。
已經觀察到端粒長度和生活方式改變之間存在大量關聯。這導致了幾項干預性研究,其中包括飲食、補充劑(如 omega-3 和核桃等)、體育鍛煉、壓力管理和社會支持。一項對認知健康的老年人使用富含核桃的飲食進行的為期兩年的試驗顯示,與對照飲食相比,保留端粒長度的趨勢不顯著 [ 19 ]。在另一項評估老年人 12 周低頻爆發式抗阻訓練效果的研究中,干預組的端粒長度得到更好的保留,而沒有顯著增加 [ 20]]。最近的一項研究發現,六個月的有氧耐力訓練或高強度間歇訓練可使端粒長度增加 5% [ 21 ]。額外的減肥、瑜伽和壓力管理技術未能顯示出顯著的端粒長度變化 [ 22 – 25 ]。然而,大多數這些研究已顯示抗氧化活性和端粒酶活性[之間顯著相關性22 - 25 ]。
雖然許多遺傳和環境因素與端粒縮短有關,但最常見的機制是氧化應激。氧化應激可能由活性氧 (ROS) 的產生與細胞清除劑之間的不平衡引起。端粒對氧化性 DNA 損傷高度敏感,可導致端粒縮短和功能障礙 [ 26 ]。在過去的幾十年里,氧和/或氧化應激與端粒長度之間的關聯一直存在爭議。人類細胞培養研究一致表明,輕度氧化應激會加速端粒縮短,而抗氧化劑和自由基清除劑會降低端粒縮短率并延長細胞增殖壽命 [ 27]]。多項關于病理狀況(如糖尿病、炎癥性疾病、帕金森病)的臨床研究表明,氧化應激標志物、活性氧清除劑水平和端粒長度之間存在相關性 [ 28 ]。然而,健康個體并沒有表現出類似的結果 [ 29 ]。
以前曾有人建議將細胞培養物暴露于高壓環境中會誘導顯著的氧化應激和細胞過早衰老 [ 30 ]。然而,這是基于在高壓培養箱中生長的分離細胞,而不是本研究中人類復雜的生物系統。與目前的研究類似,之前對暴露于強高壓氧的潛水員進行的一項為期一年的前瞻性觀察研究表明,白細胞的端粒顯著延長 [ 31 ]。正如當前研究中所使用的,HBOT 協議利用了重復間歇性高氧暴露引起的影響,即所謂的高氧缺氧悖論 [ 13 , 18]]。這些間歇性高氧暴露誘導了一種適應性反應,其中包括抗氧化劑基因 [ 32 ] 的上調增加和抗氧化劑/清除劑的產生,這些抗氧化劑/清除劑適應增加的 ROS 生成,導致 ROS/清除劑比率逐漸變得與正常氧氣環境下的比率相似。然而,由于清除劑消除半衰期 (T 1/2 ) 顯著長于ROS的 T 1/2,在恢復到常氧后,重復高氧暴露后,清除劑水平顯著升高,抗氧化活性增加 [ 13] , 18]。因此,類似于體育鍛煉和熱量限制,每天重復的 HBOT 方案可以誘發興奮現象。單次暴露會急劇增加 ROS 的產生,觸發抗氧化反應,而重復暴露后,反應變得保護性 [ 13 , 18 ]。
此外,間歇性高氧暴露會誘發許多在缺氧期間發生的生理反應 [ 13 ]。HBOT 誘導稱為缺氧誘導因子 (HIF) 的轉錄因子的釋放,并增加其穩定性和活性 [ 14 ]。反過來,HIF 誘導細胞級聯反應,包括血管內皮生長因子和血管生成誘導、線粒體生物發生、干細胞動員和 SIRT1 活性增加 [ 18 ]。我們的研究證實,HIF 表達增加是由重復的 HBOT 暴露誘導的,在非單一環境下,HIF 水平逐漸降低,趨向于正常化。
目前,許多通過基因或藥理學(senolytic 藥物)去除衰老細胞的干預措施已在動物模型中開發出來,正在等待對人體的安全性和有效性評估 [ 33 ]。目前的研究提出了一種非藥物方法,臨床上可用且安全性良好,可減少衰老細胞數量。我們的協議包括 2 ATA 的 60 次 100% 氧氣會話,包括每次會話期間的 3 次空氣中斷,以利用高氧缺氧悖論并最大限度地減少氧中毒的風險。有趣的是,TL和衰老細胞減少峰值在30個會議。然而,與施加的壓力、時間和 HBOT 暴露次數相關的劑量反應曲線及其與 HIF 表達及其相關再生效應的關系仍未完全了解,需要進一步研究以找到最佳的 HBOT 方案。
高壓氧療法是一種成熟的治療方式,可用于治療不愈合傷口、放射損傷以及不同的缺氧或缺血事件(如一氧化碳中毒、感染等)。近年來,從臨床前一個越來越多的證據以及臨床試驗表明高壓氧用于治療神經適應癥,包括特發性突發性感覺神經性聽力損失[功效34 ],卒中后和后創傷性腦損傷[ 35 - 41 ],中樞致敏綜合征例如纖維肌痛綜合征 [ 42 , 43 ] 和與年齡相關的認知能力下降 [ 17 ] 和阿爾茨海默病的動物模型 [ 44]]。目前的研究首次旨在評估在沒有任何功能限制性疾病的情況下對衰老人類細胞水平的生理影響。
研究限制
目前的研究有幾個局限性和優勢需要考慮。首先,必須考慮有限的樣本量。二是缺乏對照組。然而,該研究表明在 TL 和衰老細胞清除方面取得了令人印象深刻的結果,這在其他干預措施中沒有觀察到。此外,我們隊列的基線端粒長度值與老齡化人口的預期值相匹配 [ 45 – 47]。第三,效果的持續時間還有待長期隨訪確定。第四,由于選擇了用于血液保存和評估的方法,未評估端粒酶活性。然而,應該強調幾個優勢。在這項研究中,CD28 被用作衰老細胞的生物標志物,而 CD57 不能用作 T 細胞衰老的確認標志物。生物標志物是針對特定的白細胞群進行評估的,而不是使用整個 PBMC 作為一組。測量了孤立的 HBOT 效應,并監測參與者沒有進行任何生活方式改變(例如營養和運動)、藥物治療或任何其他可能作為混雜因素的干預。
總之,該研究表明,HBOT 可以誘導顯著的衰老作用,包括顯著增加端粒長度和清除衰老細胞中的衰老細胞。
材料和方法
科目
招募了 35 名沒有病理性認知能力下降的成年人,年齡在 64 歲及以上,獨立生活,功能和認知狀態良好。該研究于 2016 年至 2020 年在以色列 Shamir (Assaf-Harofeh) 醫療中心進行。納入的患者在納入之前的最后一年沒有心臟或腦血管缺血史。排除標準包括:過去三個月因任何原因接受過 HBOT 治療,過去一年有任何惡性腫瘤病史,任何病理性認知能力下降,嚴重慢性腎功能衰竭(GFR <30),未控制的糖尿病(HbA1C>8,禁食)葡萄糖>200)、免疫抑制劑、MRI禁忌癥(包括BMI>35)、主動吸煙或肺部疾病。
學習規劃
該研究方案得到了以色列沙米爾醫療中心機構審查委員會的批準。該研究是作為一項前瞻性臨床試驗進行的。在簽署知情同意書并進行基線評估后,受試者被分配到 HBOT。測量點在基線、治療方案的半點(第30次療程)、最后一次 HBOT療程的當天和 HBOT 后 1-2 周進行評估。
該研究隊列僅包括接受 HBOT 治療的患者,這是在以色列 Shamir 醫療中心研究的更大的正常老齡化人群隊列的一部分 (NCT02790541 [ 17 ])。
干預
HBOT 方案在 Multiplace Starmed-2700 室(HAUX,德國)中進行。該協議包括 60 個每日會話,三個月內每周 5 個會話。每次訓練包括在 2ATA 通過面罩呼吸 100% 氧氣 90 分鐘,每 20 分鐘呼吸 5 分鐘。壓縮/減壓速率為1米/分鐘。在試驗期間,不允許改變生活方式和飲食,也不允許調整藥物。
血液樣本
使用標準技術將全血樣本收集到 EDTA 管中,在基線、HBOT 方案的半點(第30次會話)、最后一次 HBOT 會話的當天(第60次會話)和HBOT 會話后的1-2 周上次 HBOT 會議。
外周血單個核細胞 (PBMC) 分離
使用磷酸鹽緩沖鹽水 (PBS) 稀釋全血。使用裝有 Lymphoprep 的 Leucosep 管進行密度梯度分離。然后將管在 25°C 下以 1000 x g離心10 分鐘。離心后,立即通過移液管收集細胞層(血沉棕黃層)并轉移到 50 mL 錐形離心管中,用足量的 1X PBS 重懸至 50 mL,并在 25°C 度下以 300× g離心10 分鐘。去除上清液后,對每個樣品進行標記。
端粒長度
根據 Dako PNA/FITC 試劑盒協議(代碼 K5327)標記端粒。在由 PBMC(樣品細胞)和 TCL 1301 細胞系(對照細胞)的混合物組成的單細胞懸液上,DNA 在微量離心管中在 82°C 下變性 10 分鐘,在沒有探針的雜交溶液中或在含有熒光素偶聯的 PNA 端粒探針的雜交溶液中。雜交在室溫 (RT) 下在黑暗中進行過夜。雜交后用 40°C 的洗滌液進行兩次 10 分鐘的雜交后洗滌。然后在適當的緩沖液中用 CD4+、CD8+、CD3+、CD19+ 和 CD56+ 偶聯抗體標記樣品,以進行進一步的流式細胞術分析 [ 48 , 49]。每個樣品一式兩份運行。流式細胞術分析后,計算 CD3+/CD4+(T 輔助細胞)、CD3+/CD8+(T-細胞毒性)、CD3+/CD56+(自然殺傷細胞)和 CD19+(B 細胞)的相對端粒長度 (RTL)。RTL 值計算為每個樣品的端粒信號與對照細胞(TCL 1301 細胞系)的比值,并校正 G0/1 細胞的 DNA 指數。使用碘化丙啶染色分別分析樣品細胞和對照細胞的 DNA 倍性,以標準化每個細胞的端粒末端數量,從而標準化每個染色體的端粒長度。有關FACS 分析示例,請參見圖 4。
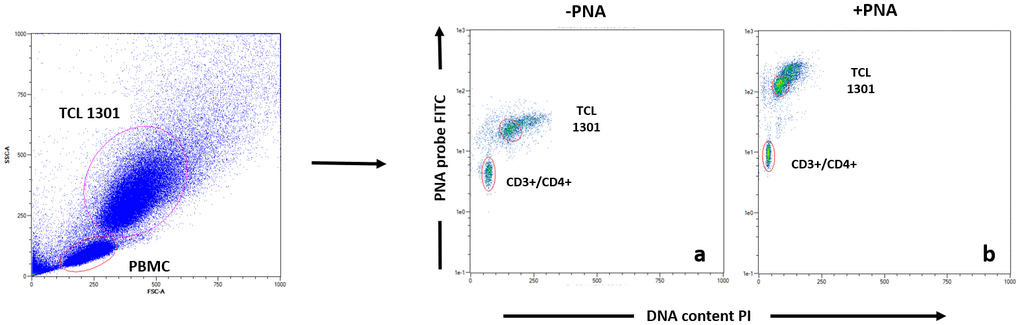
圖 4. T helper 亞群的 Flow Fish 數據分析示例。在數據采集之前,每個血樣都用 PNA 探針 ( b ) 或不使用 ( a ) 染色,然后進行抗體染色(CD3、CD4、CD8、CD16、CD19)。
免疫表型
CD3+CD4+CD28-null T 細胞(衰老 T 輔助細胞)和 CD3+CD8+CD28-null T 細胞(衰老 T 細胞毒物)的百分比通過流式細胞術分析確定。PBMC 用 VioBlue 偶聯抗 CD3、Viogreen 偶聯抗 CD8、PE-VIO 770A 偶聯抗 CD4 和 APC-VIO 770A 抗 CD28 抗體(Miltenyi Biotec)染色。用 MACSQuant 流式細胞儀 (Miltenyi Biotec) 分析細胞。然后計算 CD4+ 或 CD8+ T 細胞群中 CD28null T 細胞的百分比。
缺氧誘導因子(HIF-1alpha)
在固定和透化(Life Technologies)后,用 APC 偶聯的抗 HIF1a 抗體或相應的同種型對照(研發系統)進行細胞內 HIF1a 染色。用 MACSQuant 流式細胞儀 (Miltenyi Biotec) 分析細胞,并確定表達 HIF1a 的 PBMC 的百分比。
統計分析
除非另有說明,連續數據表示為平均值±標準差。使用 Kolmogorov-Smirnov 檢驗測試所有變量的正態分布。進行單向方差分析以比較基線時三組之間和三組內的變量。
分類數據以數字和百分比表示,并通過卡方檢驗進行比較。使用卡方/費舍爾精確檢驗進行單變量分析以確定顯著變量(P<0.05)。
為了評估 HBOT 的效果,使用重復測量方差分析模型來測試主要的受試者內效應。對均值進行事后檢驗以使用帶有 Bonferroni 校正的 t 檢驗來檢驗時間差異。
作者貢獻
所有作者都為本手稿的準備做出了重大貢獻。HY、HA、ES 負責協議設計。HA、ZY、BY、ES、DKM 負責患者招募。YH、AHR、SM、YY、SM、ZR、ESW、HA、DKM、SG、BGR、DG、HY、AHR、FG、LE、PN、DK、FM、ZY、BY負責數據采集。哈,哈。ES負責數據分析。所有作者都解釋了數據。HY、HA、CM 和 ES 撰寫了手稿。所有作者都修改并完成了手稿。
致謝
我們要感謝 Mechael Kanovsky 博士對這份手稿的編輯。
利益沖突
AH, BY, ZY 為 AVIV Scientific LTD 工作。ES 是 AVIV Scientific LTD 的股東。
資金
該研究由 Sami Sagol 先生建立的 Sagol 神經科學網絡的研究資助資助。
參考
-
1. López-Otín C, Blasco MA, Partridge L, Serrano M, Kroemer G. The hallmarks of aging. Cell. 2013; 153:1194–217.a https://doi.org/10.1016/j.cell.2013.05.039 [PubMed]
2. Tsoukalas D, Fragkiadaki P, Docea AO, Alegakis AK, Sarandi E, Vakonaki E, Salataj E, Kouvidi E, Nikitovic D, Kovatsi L, Spandidos DA, Tsatsakis A, Calina D. Association of nutraceutical supplements with longer telomere length. Int J Mol Med. 2019; 44:218–26. https://doi.org/10.3892/ijmm.2019.4191 [PubMed]
3. Starkweather AR, Alhaeeri AA, Montpetit A, Brumelle J, Filler K, Montpetit M, Mohanraj L, Lyon DE, Jackson-Cook CK. An integrative review of factors associated with telomere length and implications for biobehavioral research. Nurs Res. 2014; 63:36–50. https://doi.org/10.1097/NNR.0000000000000009 [PubMed]
4. Puhlmann LM, Valk SL, Engert V, Bernhardt BC, Lin J, Epel ES, Vrticka P, Singer T. Association of short-term change in leukocyte telomere length with cortical thickness and outcomes of mental training among healthy adults: a randomized clinical trial. JAMA Netw Open. 2019; 2:e199687. https://doi.org/10.1001/jamanetworkopen.2019.9687 [PubMed]
5. ?str?m MJ, von Bonsdorff MB, Per?l? MM, Salonen MK, Rantanen T, Kajantie E, Simonen M, Pohjolainen P, Haapanen MJ, Guzzardi MA, Iozzo P, Kautiainen H, Eriksson JG. Telomere length and physical performance among older people-the helsinki birth cohort study. Mech Ageing Dev. 2019; 183:111145. https://doi.org/10.1016/j.mad.2019.111145 [PubMed]
6. Xie Z, Jay KA, Smith DL, Zhang Y, Liu Z, Zheng J, Tian R, Li H, Blackburn EH. Early telomerase inactivation accelerates aging independently of telomere length. Cell. 2015; 160:928–39. https://doi.org/10.1016/j.cell.2015.02.002 [PubMed]
7. Goglin SE, Farzaneh-Far R, Epel ES, Lin J, Blackburn EH, Whooley MA. Change in leukocyte telomere length predicts mortality in patients with stable coronary heart disease from the heart and soul study. PLoS One. 2016; 11:e0160748. https://doi.org/10.1371/journal.pone.0160748 [PubMed]
8. Armanios M. Telomeres and age-related disease: how telomere biology informs clinical paradigms. J Clin Invest. 2013; 123:996–1002. https://doi.org/10.1172/JCI66370 [PubMed]
9. Richards JB, Valdes AM, Gardner JP, Paximadas D, Kimura M, Nessa A, Lu X, Surdulescu GL, Swaminathan R, Spector TD, Aviv A. Higher serum vitamin D concentrations are associated with longer leukocyte telomere length in women. Am J Clin Nutr. 2007; 86:1420–25. https://doi.org/10.1093/ajcn/86.5.1420 [PubMed]
10. Bodnar AG, Ouellette M, Frolkis M, Holt SE, Chiu CP, Morin GB, Harley CB, Shay JW, Lichtsteiner S, Wright WE. Extension of life-span by introduction of telomerase into normal human cells. Science. 1998; 279:349–52. https://doi.org/10.1126/science.279.5349.349 [PubMed]
11. Townsley DM, Dumitriu B, Liu D, Biancotto A, Weinstein B, Chen C, Hardy N, Mihalek AD, Lingala S, Kim YJ, Yao J, Jones E, Gochuico BR, et al. Danazol treatment for telomere diseases. N Engl J Med. 2016; 374:1922–31. https://doi.org/10.1056/NEJMoa1515319 [PubMed]
12. Coutts F, Palmos AB, Duarte RR, de Jong S, Lewis CM, Dima D, Powell TR. The polygenic nature of telomere length and the anti-ageing properties of lithium. Neuropsychopharmacology. 2019; 44:757–65. https://doi.org/10.1038/s41386-018-0289-0 [PubMed]
13. Cimino F, Balestra C, Germonpré P, De Bels D, Tillmans F, Saija A, Speciale A, Virgili F. Pulsed high oxygen induces a hypoxic-like response in human umbilical endothelial cells and in humans. J Appl Physiol (1985). 2012; 113:1684–89. https://doi.org/10.1152/japplphysiol.00922.2012 [PubMed]
14. Sunkari VG, Lind F, Botusan IR, Kashif A, Liu ZJ, Yl?-Herttuala S, Brismar K, Velazquez O, Catrina SB. Hyperbaric oxygen therapy activates hypoxia-inducible factor 1 (HIF-1), which contributes to improved wound healing in diabetic mice. Wound Repair Regen. 2015; 23:98–103. https://doi.org/10.1111/wrr.12253 [PubMed]
15. Milovanova TN, Bhopale VM, Sorokina EM, Moore JS, Hunt TK, Hauer-Jensen M, Velazquez OC, Thom SR. Hyperbaric oxygen stimulates vasculogenic stem cell growth and differentiation in vivo. J Appl Physiol (1985). 2009; 106:711–28. https://doi.org/10.1152/japplphysiol.91054.2008 [PubMed]
16. Yang Y, Wei H, Zhou X, Zhang F, Wang C. Hyperbaric oxygen promotes neural stem cell proliferation by activating vascular endothelial growth factor/extracellular signal-regulated kinase signaling after traumatic brain injury. Neuroreport. 2017; 28:1232–38. https://doi.org/10.1097/WNR.0000000000000901 [PubMed]
17. Hadanny A, Daniel-Kotovsky M, Suzin G, Boussi-Gross R, Catalogna M, Dagan K, Hachmo Y, Abu Hamed R, Sasson E, Fishlev G, Lang E, Polak N, Doenyas K, et al. Cognitive enhancement of healthy older adults using hyperbaric oxygen: a randomized controlled trial. Aging (Albany NY). 2020; 12:13740–61. https://doi.org/10.18632/aging.103571 [PubMed]
18. Hadanny A, Efrati S. The hyperoxic-hypoxic paradox. Biomolecules. 2020; 10:958. https://doi.org/10.3390/biom10060958 [PubMed]
19. Freitas-Simoes TM, Cofán M, Blasco MA, Soberón N, Foronda M, Serra-Mir M, Roth I, Valls-Pedret C, Doménech M, Ponferrada-Ariza E, Calvo C, Rajaram S, Sabaté J, et al. Walnut consumption for two years and leukocyte telomere attrition in mediterranean elders: results of a randomized controlled trial. Nutrients. 2018; 10:1907. https://doi.org/10.3390/nu10121907 [PubMed]
20. Dimauro I, Scalabrin M, Fantini C, Grazioli E, Beltran Valls MR, Mercatelli N, Parisi A, Sabatini S, Di Luigi L, Caporossi D. Resistance training and redox homeostasis: correlation with age-associated genomic changes. Redox Biol. 2016; 10:34–44. https://doi.org/10.1016/j.redox.2016.09.008 [PubMed]
21. Werner CM, Hecksteden A, Morsch A, Zundler J, Wegmann M, Kratzsch J, Thiery J, Hohl M, Bittenbring JT, Neumann F, B?hm M, Meyer T, Laufs U. Differential effects of endurance, interval, and resistance training on telomerase activity and telomere length in a randomized, controlled study. Eur Heart J. 2019; 40:34–46. https://doi.org/10.1093/eurheartj/ehy585 [PubMed]
22. Sanft T, Usiskin I, Harrigan M, Cartmel B, Lu L, Li FY, Zhou Y, Chagpar A, Ferrucci LM, Pusztai L, Irwin ML. Randomized controlled trial of weight loss versus usual care on telomere length in women with breast cancer: the lifestyle, exercise, and nutrition (LEAN) study. Breast Cancer Res Treat. 2018; 172:105–12. https://doi.org/10.1007/s10549-018-4895-7 [PubMed]
23. Mason C, Risques RA, Xiao L, Duggan CR, Imayama I, Campbell KL, Kong A, Foster-Schubert KE, Wang CY, Alfano CM, Blackburn GL, Rabinovitch PS, McTiernan A. Independent and combined effects of dietary weight loss and exercise on leukocyte telomere length in postmenopausal women. Obesity (Silver Spring). 2013; 21:E549–54. https://doi.org/10.1002/oby.20509 [PubMed]
24. Krishna BH, Keerthi GS, Kumar CK, Reddy NM. Association of leukocyte telomere length with oxidative stress in yoga practitioners. J Clin Diagn Res. 2015; 9:CC01–03. https://doi.org/10.7860/JCDR/2015/13076.5729 [PubMed]
25. Tehfe M, Dowden S, Kennecke H, El-Maraghi R, Lesperance B, Couture F, Letourneau R, Liu H, Romano A. Erratum to: nab-paclitaxel plus gemcitabine versus gemcitabine in patients with metastatic pancreatic adenocarcinoma: canadian subgroup analysis of the phase 3 MPACT trial. Adv Ther. 2017; 34:277–79. https://doi.org/10.1007/s12325-016-0442-2 [PubMed]
26. Barnes RP, Fouquerel E, Opresko PL. The impact of oxidative DNA damage and stress on telomere homeostasis. Mech Ageing Dev. 2019; 177:37–45. https://doi.org/10.1016/j.mad.2018.03.013 [PubMed]
27. von Zglinicki T. Oxidative stress shortens telomeres. Trends Biochem Sci. 2002; 27:339–44. https://doi.org/10.1016/s0968-0004(02)02110-2 [PubMed]
28. Sampson MJ, Winterbone MS, Hughes JC, Dozio N, Hughes DA. Monocyte telomere shortening and oxidative DNA damage in type 2 diabetes. Diabetes Care. 2006; 29:283–89. https://doi.org/10.2337/diacare.29.02.06.dc05-1715 [PubMed]
29. Reichert S, Stier A. Does oxidative stress shorten telomeres in vivo? a review. Biol Lett. 2017; 13:20170463. https://doi.org/10.1098/rsbl.2017.0463 [PubMed]
30. Oh S, Lee E, Lee J, Lim Y, Kim J, Woo S. Comparison of the effects of 40% oxygen and two atmospheric absolute air pressure conditions on stress-induced premature senescence of normal human diploid fibroblasts. Cell Stress Chaperones. 2008; 13:447–58. https://doi.org/10.1007/s12192-008-0041-5 [PubMed]
31. Shlush LI, Skorecki KL, Itzkovitz S, Yehezkel S, Segev Y, Shachar H, Berkovitz R, Adir Y, Vulto I, Lansdorp PM, Selig S. Telomere elongation followed by telomere length reduction, in leukocytes from divers exposed to intense oxidative stress—implications for tissue and organismal aging. Mech Ageing Dev. 2011; 132:123–30. https://doi.org/10.1016/j.mad.2011.01.005 [PubMed]
32. Godman CA, Joshi R, Giardina C, Perdrizet G, Hightower LE. Hyperbaric oxygen treatment induces antioxidant gene expression. Ann N Y Acad Sci. 2010; 1197:178–83. https://doi.org/10.1111/j.1749-6632.2009.05393.x [PubMed]
33. Pignolo RJ, Passos JF, Khosla S, Tchkonia T, Kirkland JL. Reducing senescent cell burden in aging and disease. Trends Mol Med. 2020; 26:630–38. https://doi.org/10.1016/j.molmed.2020.03.005 [PubMed]
34. LE W. Hyperbaric Oxygen Therapy Indications. UHMS. 2008; 12th edition:215–218.
35. Boussi-Gross R, Golan H, Fishlev G, Bechor Y, Volkov O, Bergan J, Friedman M, Hoofien D, Shlamkovitch N, Ben-Jacob E, Efrati S. Hyperbaric oxygen therapy can improve post concussion syndrome years after mild traumatic brain injury - randomized prospective trial. PLoS One. 2013; 8:e79995. https://doi.org/10.1371/journal.pone.0079995 [PubMed]
36. Efrati S, Fishlev G, Bechor Y, Volkov O, Bergan J, Kliakhandler K, Kamiager I, Gal N, Friedman M, Ben-Jacob E, Golan H. Hyperbaric oxygen induces late neuroplasticity in post stroke patients—randomized, prospective trial. PLoS One. 2013; 8:e53716. https://doi.org/10.1371/journal.pone.0053716 [PubMed]
37. Mukherjee A, Raison M, Sahni T, Arya A, Lambert J, Marois P, James PB, Parent A, Ballaz L. Intensive rehabilitation combined with HBO2 therapy in children with cerebral palsy: a controlled longitudinal study. Undersea Hyperb Med. 2014; 41:77–85. [PubMed]
38. Hadanny A, Golan H, Fishlev G, Bechor Y, Volkov O, Suzin G, Ben-Jacob E, Efrati S. Hyperbaric oxygen can induce neuroplasticity and improve cognitive functions of patients suffering from anoxic brain damage. Restor Neurol Neurosci. 2015; 33:471–86. https://doi.org/10.3233/RNN-150517 [PubMed]
39. Tal S, Hadanny A, Berkovitz N, Sasson E, Ben-Jacob E, Efrati S. Hyperbaric oxygen may induce angiogenesis in patients suffering from prolonged post-concussion syndrome due to traumatic brain injury. Restor Neurol Neurosci. 2015; 33:943–51. https://doi.org/10.3233/RNN-150585 [PubMed]
40. Hadanny A, Rittblat M, Bitterman M, May-Raz I, Suzin G, Boussi-Gross R, Zemel Y, Bechor Y, Catalogna M, Efrati S. Hyperbaric oxygen therapy improves neurocognitive functions of post-stroke patients - a retrospective analysis. Restor Neurol Neurosci. 2020; 38:93–107. https://doi.org/10.3233/RNN-190959 [PubMed]
41. Tal S, Hadanny A, Sasson E, Suzin G, Efrati S. Hyperbaric oxygen therapy can induce angiogenesis and regeneration of nerve fibers in traumatic brain injury patients. Front Hum Neurosci. 2017; 11:508. https://doi.org/10.3389/fnhum.2017.00508 [PubMed]
42. Efrati S, Golan H, Bechor Y, Faran Y, Daphna-Tekoah S, Sekler G, Fishlev G, Ablin JN, Bergan J, Volkov O, Friedman M, Ben-Jacob E, Buskila D. Hyperbaric oxygen therapy can diminish fibromyalgia syndrome—prospective clinical trial. PLoS One. 2015; 10:e0127012. https://doi.org/10.1371/journal.pone.0127012 [PubMed]
43. Hadanny A, Bechor Y, Catalogna M, Daphna-Tekoah S, Sigal T, Cohenpour M, Lev-Wiesel R, Efrati S. Hyperbaric oxygen therapy can induce neuroplasticity and significant clinical improvement in patients suffering from fibromyalgia with a history of childhood sexual abuse-randomized controlled trial. Front Psychol. 2018; 9:2495. https://doi.org/10.3389/fpsyg.2018.02495 [PubMed]
44. Shapira R, Efrati S, Ashery U. Hyperbaric oxygen therapy as a new treatment approach for Alzheimer’s disease. Neural Regen Res. 2018; 13:817–18. https://doi.org/10.4103/1673-5374.232475 [PubMed]
45. Steenstrup T, Kark JD, Verhulst S, Thinggaard M, Hjelmborg JV, Dalg?rd C, Kyvik KO, Christiansen L, Mangino M, Spector TD, Petersen I, Kimura M, Benetos A, et al. Telomeres and the natural lifespan limit in humans. Aging (Albany NY). 2017; 9:1130–42. https://doi.org/10.18632/aging.101216 [PubMed]
46. Shammas MA. Telomeres, lifestyle, cancer, and aging. Curr Opin Clin Nutr Metab Care. 2011; 14:28–34. https://doi.org/10.1097/MCO.0b013e32834121b1 [PubMed]
47. Teubel I, Elchinova E, Roura S, Fernández MA, Gálvez-Montón C, Moliner P, de Antonio M, Lupón J, Bayés-Genís A. Telomere attrition in heart failure: a flow-FISH longitudinal analysis of circulating monocytes. J Transl Med. 2018; 16:35. https://doi.org/10.1186/s12967-018-1412-z [PubMed]
48. Baerlocher GM, Lansdorp PM. Telomere length measurements in leukocyte subsets by automated multicolor flow-FISH. Cytometry A. 2003; 55:1–6. https://doi.org/10.1002/cyto.a.10064 [PubMed]
49. Baerlocher GM, Lansdorp PM. Telomere length measurements using fluorescence in situ hybridization and flow cytometry. Methods Cell Biol. 2004; 75:719–50. https://doi.org/10.1016/s0091-679x(04)75031-1 [PubMed]